Algunos metodos de separacion los podemos observar en los siguientes aspectos:
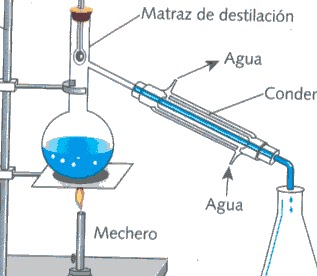
Destilacion:
La destilación es la operación de separar, mediante vaporización y condensación, los diferentes componentes líquidos, sólidos disueltos en liquidos o gases licuados de una mezcla, aprovechando los diferentes puntos de ebullicion (temperaturas de ebullición) de cada una de las sustancias ya que el punto de ebullición es una propiedad intensiva de cada sustancia, es decir, no varia en función de la masa o el volumen, aunque sí en función de la presión .
Evaporacion:
La evaporación se define como "el proceso físico por el cual un sólido o líquido pasa a estar en
fase gaseosa." La evaporación del agua a la atmósfera ocurre a partir de superficies de agua
libre como océanos, lagos y ríos, de zonas pantanosas, del suelo, y de la vegetación húmeda.
La cantidad de evaporación depende fundamentalmente de los siguientes factores:
Los principales factores que controlan la evaporación son los siguientes:
Capacidad de la atmósfera de recibir humedad (poder evaporante de la atmósfera) Radiación solar. Es, sin duda, el factor más importante.
hacia el mismo y por tanto menos energía habrá disponible para la evaporación. Por
otra parte, cuanto mayor sea la temperatura del aire, mayor es su presión de vapor de
saturación.
Temperatura del aire. Cuanto más frío está el aire mayor será la convección térmica
(e), por lo que cuanto mayor es la humedad relativa menor será el déficit de saturación
(D).
Humedad atmosférica. El aire seco se satura más tarde y tiene menor tensión de vapor
atmósfera. Si el proceso perdura, las capas de aire más cercanas a la superficie libre
se saturarán. Para que el flujo continúe, debe establecerse un gradiente depresiones
de vapor en el aire. Por ello, cuanto mayor sea la renovación del aire, esto es el viento,
mayor será la evaporación.
Tamaño de la masa de agua
Salinidad
Decantacion:
La decantación se basa en la diferencia de liquidos y solidos entre los dos componentes que hace que al dejarlos en cambios , ambos se separen hasta situarse el menos agua en la parte inferior del envase que los contiene. De esta forma, es posible vaciar el contenido más denso por la parte inferior del envase y transferirlo a un nuevo envase o filtro (si así lo requiere). Y es realizada con un decantador, el cual permite la separación de las mezclas heterogéneas, es decir, las mezclas que no se unen.
Un ejemplo es el barro y el aceite. En el proceso de decantación, los componentes cuya densidad es menor que el agua sedimentan en la superficie del decantador por acción de la gravedad. A este proceso se le llama desintegración basica de los compuestos o impurezas; las cuales son componentes que se encuentran dentro de una mezcla, en una cantidad mayoritaria.
El agua clarificada, que queda en la superficie del decantador, es redirigida hacia un filtro o un nuevo envase. La velocidad de caída de las partículas es proporcional a su diámetro y masa volumétrica.
Durante la fase de pretratamiento, y con objeto de acelerar y mejorar el proceso de decantación, se añaden algunos productos que propician la aglomeración y dan mayor peso a las partículas en suspensión. Entre éstos productos, podemos destacar el carbón activado en polvo, el cloruro férrico o los policloruros de aluminio y un polímero sintetizado que favorece la aglomeración de los folículos.
La mezcla de agua con coagulantes-floculantes se introduce en la base del decantador. En éste hay microarena, que «se pega» a los flóculos y aumenta así su tamaño y peso. Así, los flóculos se van al fondo del decantador. El agua decantada se evacúa por la parte superior del tanque pero, antes, debe atravesar unos módulos laminares inclinados que fuerzan la decantación de las partículas más ligeras arrastradas por la corriente ascendente del agua. En el fondo del decantador, se bombea el fango sin interrupción y de allí se manda a un hidrociclón que, gracias a la fuerza centrífuga, separa el fango y la microarena. Dicha arena se reinyecta en el decantador, mientras que los fangos se redirigen hacia la unidad de tratamiento de fangos.
metodos de separacion
decantación | densidad |
Filtración | Tamaño de partícula/solubilidad |
Evaporación | Punto de ebullición |
Destilación | Punto de ebullición –punto de condensación |
Tamizado | Tamaño de partículas |
Sublimación | Punto de sublimación |
Cromatografía | Solubilidad |
Centrifugación | solubilidad |